- HOME
- Blog Letter
제조용수 관리 및 WELGENE의 제조용수
-
웰진
/
-
2025-04-04 (17:40)
/
-
2208 hit
/
-


|
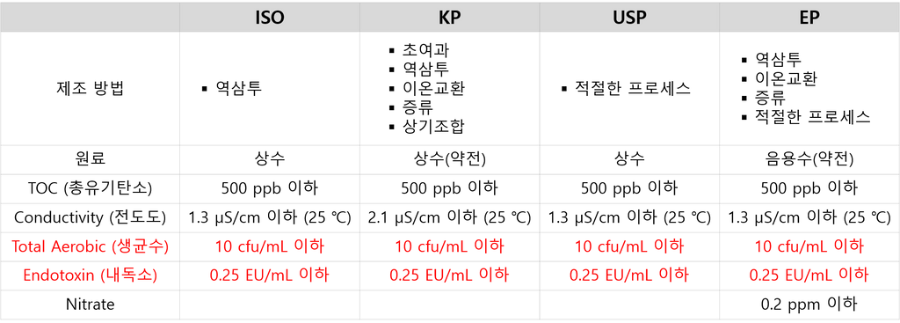
완제의약품 제조 및 품질관리기준(GMP) 상 공정 중 사용하는 물(정제수, 주사용수 등)은 완제품에 잔류하지 않더라도 제조공정 중 의약품과 직접 접촉 또는 반응하여 제품의 품질에 영향 (예 : 원료약품의 용해 또는 잔류에 의한 영향)을 미칠 수 있기 때문에 완제품의 구성성분으로 존재하게 되는 원료약품과 동등하게 관리하여야 합니다. 제조용수의 구분 전세계적으로 국가 및 국제 기관들은 일반적으로 상수(Water), 정제수(Purified Water) 및 주사용수(Water for Injection)로 분류하여 각 등급별 수질 표준을 규정하여 관리하고 있습니다. 이 중 미국약전 협약은 매년 미국 약전(USP)를 발행하며, 미국에서 제조 및 판매되는 처방전, 일반의약품, 화장품 및 건강 관리 제품 등 공중 보건에 있어 중요한 제품의 품질, 순도, 강도 및 일관성에 대한 표준을 설정합니다. 현재 이런 USP는 세계 130여 개국 이상에서 표준 및 인증에 사용되고 있습니다. (1) 상수(Water): [먹는물 관리법]의 먹는물 수질 기준에 적합하여야 한다. (암모늄 0.05mg/L 이하 등) (2) 정제수(Purified Water): 이온교환, 증류, 역삼투(Reverse Osmosis) 또는 한외여과 등을 단독 또는 조합시킨 시스템에 의해 상수로부터 만든다. (유기탄소 0.5mg/L 이하, 전도율 2.1uS/cm 이하 등) (3) 주사용수(Water for Injection): 정제수의 증류(Distillation) 또는 초여과법(Ultrafiltration)을 통해 만든다. 초여과법으로 제조할 시 미생물에 의한 오염에 주의해야 한다. (유기탄소 0.5mg/L 이하, 전도율 2.1uS/cm 이하, 엔도톡신 0.25EU/mL 미만 등) 국가별 제조용수의 규격 제조용수 분류 중 의약, 의료기기 등에 제조 및 시험 등에 사용되는 주사용수의 각 나라별 규격은 다음과 같습니다.
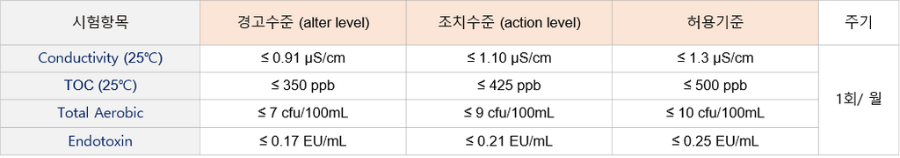
웰진의 제조용수 관리 WELGENE은 연수한 상수를 Fiber 및 Carbon filter를 통과시켜 1차 정제 후 역삼투(RO Filtration)를 통한 2차 정제, Carbon cartridge, EX cartridge 및 Charged cartridge 를 통한 3차 정제 후 제품의 제조, 생산용 용기 및 기구 등의 세척 및 품질관리 시험용으로 사용하고 있으며, KP 및 USP, EP의 WFI(Water For Injection) 등급 규격에 맞는 유효성 검증 Validation을 주기적으로 실시하여 관리하고 있습니다.
WELGENE의 WATER 제품 웰진의 Ultra Pure Water는 역삼투(reverse osmosis, RO) 여과과정, 2단계의 이온교환 여과과정 거쳐 최종적으로 max. 18MΩ의 저항값(전도도: 0.056μS/cm)을 가집니다. 웰진의 Ultra Pure Water는 0.2μm filtration의 멸균 공정을 통하여 균체는 물론 기타의 불순물도 완전히 제거하였으므로 물로 인하여 발생할 수 있는 실험상의 오류를 방지할 수 있고 높은 재현성을 제공합니다. 웰진의 Ultra Pure Water는 각종 액체시약의 제조, PCR ligation, restriction enzyme 반응 등 분자생물학 실험의 다양한 분야에 사용할 수 있습니다.
|
Blog Letter
|
|