- HOME
- Blog Letter
mRNA 기반 CAR-T: mRNA 기반 CAR-T의 가능성과 한계
-
웰진
/
-
2025-06-23 (08:30)
/
-
2878 hit
/
-


|
바이럴 백터 없이 CAR-T를 만든다? – mRNA 기반 CAR-T의 가능성과 한계
요즘 면역세포치료제 연구를 하다 보면, CAR-T의 주사기에서 mRNA가 나올지도 모르겠다는 농담이 나옵니다. 그만큼 CAR-T 세포 제조에 있어 mRNA 기반 접근법이 빠르게 주목받고 있습니다. 우리가 익히 아는 CAR-T는 보통 렌티바이러스나 레트로바이러스 벡터를 통해 CAR 유전자를 T세포에 넣고, 이를 체외에서 확장한 뒤 환자에게 되돌려주는 방식이었죠. 하지만 여기에는 항상 따라붙는 문제가 있었습니다. 1. 유전자 삽입에 따른 삽입 돌연변이 위험 2. 벡터 제조 공정의 복잡성 및 GMP 비용 문제 3. 영구 발현으로 인한 제어 어려움 (예: 사이토카인 폭풍 조절 어려움)
이러한 상황에서 떠오른 것이 바로, “바이럴 벡터 없이, mRNA만으로 CAR를 발현시키는 방법”입니다.
그럼 mRNA 기반 CAR-T는 기존 CAR-T와 어떻게 다른가요? mRNA를 통해 CAR 단백질을 발현시키는 방식은 기존 유전자 삽입이 아닌 일시적인 발현에 기반합니다. 즉, 천기천공 (Electroporation)이나 리포펙션을 통해 mRNA를 T 세포에 주입하면, 수일 간 CAR가 발현되고 이후 점차 사라집니다. 장점으로는 다음과 같은 점이 있습니다. 1. 빠른 제조 속도: 바이러스 벡터 필요 없음 → 2~3일 이내 제조 가능 2. 안전성 향상: 유전자 삽입 없음 → 삽입 돌연변이 위험 없음 3. 제어 용이성: CAR 발현이 일시적 → 부작용 시 조절 가능 4. 반복 투여 가능성: 일회성 발현이므로 반복 주입 가능
하지만, 이런 장점 외에 단점도 존재합니다. 1. 지속성 부족: 수일 내 CAR 발현 소실 → 반복 투여 필요 2. 효능 유지 어려움: 장기간 효과를 기대하는 암종에서는 불리 3. 전기천공/전달 기술 한계: 효율적 transfection이 여전히 도전 과제
그럼에도 불구하고, 이 방식은 특히 고형암 타겟 치료나 자가면역질환 조절용 T세포 치료제에서 매우 유망한 접근으로 떠오르고 있습니다. 특히 최근에는 mRNA 기반 CAR-T 기술이 Moderna, BioNTech, 그리고 국내 기업들까지 손을 뻗고 있어, ‘차세대 비바이러스 기반 세포치료제 플랫폼’이라는 개념으로 재조명되고 있습니다.
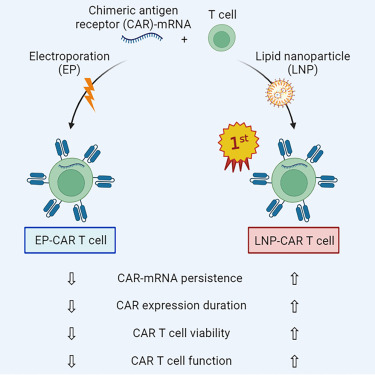
그럼 여기에서 T세포에 mRNA를 도입하는 방식에 대해 알아보겠습니다.
mRNA 기반
CAR-T”에서 T세포에 mRNA를 도입하는
방식은 치료 효율과
안전성을 좌우하는 핵심 요소입니다. 아래에 이 두 방식의 차이를 구조적으로 정리해 드리겠습니다.
한편, 전기천공 방식의 장점 및 단점은 다음과 같습니다. 장점은 1) 고효율 mRNA 도입으로 CAR 발현률 제고, 2) 수 시간 이내 발현 가능, 3) 기존 GMP-grade 장비 (Lonza Nucleofector, MaxCyte)를 기반으로 빠른 translation이 가능합니다. 반면에 단점으로는 1) 전기 스트레스로 인한 T세포 활성 감소, 2) naive T세포, Tscm 세포군에는 독성이 더 큼, 3) 대량 생산 시 비효율적 (cell loss 상승)이라는 점을 들 수 있습니다. LNP 나노입자 방식의 장점으로는 1) 전기 손상이 없어 T세포 생존율과 기능 보존이 가능, 2) 제조가 간단 (혼합형 프로토콜로 가능), 3) 면역세포 subset별 선택적 전달 가능성 (최적화 시)을 들 수 있으며, 단점으로는 1) 아직 T세포 투과율이 낮아 효율 개선이 필요, 2) cationic lipid toxicity, endosomal escape 문제 해결 필요, 3) GMP-grade LNP 시스템 구축이 필요하다는 점을 들 수 있습니다. 실례로 Cartesian Bio에서는 전기천공법을 이용하여 Descartes-11, Descartes-25 등 mRNA CAR-T를 개발 중에 있으며, Moderna 및 BioNTech에서는 LNP 기반 시스템을 활용하여 mRNA-encoded TCR 시도 및 DC나 T세포에 RNA를 전달하는 플랫폼 preclinical을 진행 중에 있습니다.
한편, mRNA 기반 CAR-T의 실제 임상 적용 사례도 있는데요. 간략하게 설명 드리겠습니다. 앞서 설명 드렸듯이 Cartesian Therapeutics에서는 Descartes-11 & Descartes-25를 전기천공법으로 T세포에 mRNA를 도입하여 임상시험을 진행 중에 있습니다. 각각의 임상정보는 Descartes-11: Phase 1 완료 (NCT03451916) 및 Descartes-25: Autoimmune disease에 적용 (NCT05352828)입니다. 그리고, 펜실베이아 대학과 Tmunity Therapeutics가 공동으로 폐암, 췌장암, 난소암 환자를 대상으로 한 임상1상 시험이 진행 중에 있습니다 (NCT01355965). 이 임상시험은 mRNA로 인한 일시적 발현 덕분에 고형암에서 과잉 활성 면역반응 최소화와 일부 환자에서 반응 확인 (stable disease or partial response)을 했다는 특징을 가진 임상시험입니다.
mRNA 기반 CAR-T는
아직 초창기지만, 임상 데이터가
실제로 누적되기 시작했다는 점이 매우 중요합니다.
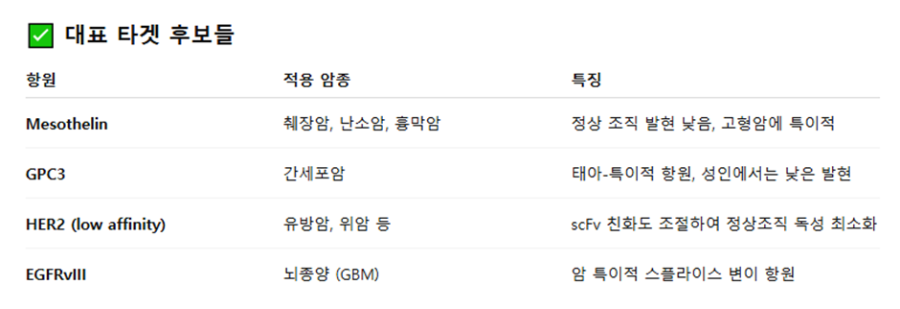
마지막으로 mRNA 기반 CAR-T 기술을 고형암 (solid tumor)에 적용하기 위한 전략을 다루는 방법에 대해 얘기해 보겠습니다. CAR-T는 혈액암, 특히 CD19+ B세포성 백혈병과 림프종에서 엄청난 성과를 거뒀습니다. 하지만 고형암에서는 아직까지 뚜렷한 임상적 성공 사례가 드뭅니다. 그 이유는 다음과 같습니다: n 암세포와 정상세포의 항원 중복 문제 (on-target/off-tumor toxicity) n 암 조직의 면역억제 미세환경 (TME) n 암 조직 내 침투성 부족 n CAR 발현 조절의 어려움으로 인한 과도한 면역 반응 이런 점을 해결하고자 mRNA CAR-T를 활용하여 조직 특이적 타겟팅이 시작되었는데요. 아마도 mRNA는 일시적으로만 CAR를 발현시켜 조직 특이성이 낮더라도 지속적 독성 발생을 방지할 수 있고, 부작용 발생 시 투여를 중단할 수 있어 효과를 자연 소실할 수 있으며, 반복 주입을 통한 조절 가능성 확보가 가능하기 때문일 것으로 생각됩니다. 일단, 고형암은 B세포처럼 명확한 항원이 없기 때문에, 정상 조직과 차별되는 조직 특이적 항원을 찾아야 합니다. 대표적인 타겟 후보들은 다음과 같습니다.
또한, 단순히 표적 CAR를 만들 뿐 아니라, 그 CAR-T가 특정 조직에만 도달하도록 유도하는 전략도 중요합니다. 가능한 접근법으로는 1) mRNA-LNP에 조직 특이적 리간드 부착 (예: folate, RGD peptide 등), 2) CAR의 활성화 조절 (AND gate logic)을 통해 암세포에서만 두 개 항원을 동시에 인식할 때만 활성화, 3) Tumor microenvironment-responsive promoter를 사용하여 저산소, 낮은 pH 환경에서만 CAR가 발현되도록 하는 것입니다. 실제로 펜실베니아 대학에서는 mRNA Mesothelin-CAR T 전략을 사용하여 폐/췌장/난소암 환자를 대상으로 일시적 효과를 관찰한 바 있습니다. 혈액암에서 돌풍을 일으켰던 CAR-T, 고형암에서는 여전히 “넘사벽”이지만, mRNA 기술과 타겟팅 전략의 조합으로 그 벽을 깰 준비를 하고 있습니다. 아마 가까운 미래에는, 고형암 환자에게 "바이럴 벡터 없이, 일회용 CAR-T를 반복 투여해 완전 관해에 도달했다"는 뉴스도 들을 수 있겠죠.
mRNA 백신 이후, mRNA의 가능성은 더 이상 ‘불안정한 분자’가 아닌, 정밀한 세포 조작 도구로 진화하고 있습니다. CAR-T 치료의 안전성과 유연성을 높이려는 이 노력은 분명 치료 옵션의 다양성을 넓히게 될 것입니다.
|
Blog Letter
|
|